Феринжект раствор для инъекций 50 мг/мл 10 мл №1
Основные свойства
Характеристики
| Торговое название | Феринжект |
| Действующее вещество | Железа карбоксимальтозат |
| Способ введения | Инъекции |
| Количество в упаковке | 1 флакон |
| Дозировка | 50 мг/мл |
| Производитель | Vifor |
| Страна производства | Швейцария |
| Форма | Флаконы |
| Условия отпуска | По рецепту |
Инструкция Феринжект раствор для инъекций 50 мг/мл 10 мл №1
Состав
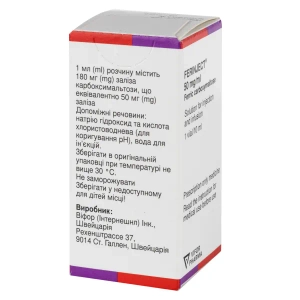
действующее вещество: железо в виде железа карбоксимальтозы;
1 мл раствора содержит 180 мг железа карбоксимальтозы, что эквивалентно 50 мг железа;
вспомогательные вещества: натрия гидроксид и кислота хлористоводородная (для корректировки рН), вода для инъекций.
Лекарственная форма
Раствор для инъекций и инфузий.
Основные физико-химические свойства: непрозрачный водный раствор темно-коричневого цвета.
Фармакотерапевтическая группа
Антианемические средства. Препараты железа. Препараты железа для парентерального введения. Код АТХ В0ЗА С.
Фармакологические свойства
Механизм действия
После внутривенного введения карбоксимальтозный комплекс железа преимущественно усваивается ретикулоэндотелиальной системой печени, костным мозгом и селезенкой. Железо используется главным образом для синтеза гемоглобина, а также миоглобина и железосодержащих ферментов, а также железо сохраняется в печени как депонированное.
Фармакодинамика
Раствор препарата Феринжект® содержит железо в стабильном состоянии - в комплексе железа (III), который состоит из полинуклеарного ядра гидроксида железа (III) с углеводным полимером, поставляющим железо, является пригодным к использованию и транспортировки железа в организме, и белки, депонирующие железо (трансферрин и ферритин). В исследовании с 59Fe - и 52Fe-меченым препаратом Феринжект® с участием 6 пациентов с железодефицитной анемией или почечной анемией было выявлено усвоение 61-99% железа эритроцитами через 24 дня после введения препарата. У пациентов с железодефицитной анемией усвоение составляло 91-99 %, а у пациентов с почечной анемией - 61-84 %.
Дети в возрасте 1-17 лет
В проспективном фармакокинетическом/фармакодинамическом исследовании фазы 2 (1VIT13036) 35 детей в группах с последовательным введением доз получали лечение путем внутривенного введения одноразовых доз лекарственного средства Феринжект® 7,5 мг железа/кг (n = 16) и Феринжект®15 мг железа/кг (n = 19) (максимальная доза составляет 750 мг железа). На 35-й день после инъекции среднее повышение (стандартное отклонение [СО]) гемоглобина составило 1,9 (1,38) г/дл при применении 7,5 мг железа/кг и 2,8 (1,15) г/дл при применении 15 мг железа/кг. Насыщение ферритина и трансферрина также увеличивалось в зависимости от дозы.
Эффективность и безопасность внутривенного введения лекарственного средства Феринжект® сравнивали с терапией пероральными препаратами железа в проспективном открытом исследовании с параллельными группами фазы 3 (1VIT17044). Сорок детей с железодефицитной анемией различной этиологии получали 2 дозы лекарственного средства Феринжект® по 15 мг железа/кг каждая с интервалом 7 дней (максимальная однократная доза составляет 750 мг), а 39 детей получали сульфат железа перорально в течение 28 дней. Семеро детей, которые должным образом не ответили на терапию пероральным препаратом железа, также получали 2 дозы лекарственного средства Феринжект® в расширенном исследовании с одной группой (1VIT18045).
В основном исследовании наблюдалось клинически значимое повышение уровня гемоглобина в обеих группах лечения. Среднее повышение уровня гемоглобина (по методу наименьших квадратов) составило 2,22 г/дл (95% ДИ: 1,69-2,75) после применения лекарственного средства Феринжект® и 1,92 г/дл (95% ДИ: 1,43-2,41) после терапии пероральными препаратами железа без статистически значимой разницы между группами лечения. Таким образом, первичная конечная точка исследования не была достигнута. Повышение вторичных конечных точек (уровень ферритина и насыщения трансферрина) было больше при применении лекарственного средства Феринжект®, чем после терапии пероральным препаратом железа. В расширенном исследовании среднее повышение [СВ] уровня гемоглобина после окончания основного исследования составило 0,7 (1,19) г/дл.
Фармакокинетика
Распределение
После введения разовой дозы препарата Феринжект®, которая содержит от 100 до 1000 мг железа, пациентам с железодефицитной анемией максимальные уровни общего железа в сыворотке крови от 37 до 333 мкг/мл достигались в течение 15 минут и 1,21 часа соответственно. Объем распределения центрального компартмента соответствовал объему плазмы крови (примерно 3 л).
Позитронно-эмиссионная томография показала, что железо радиомиченого препарата Феринжект® выводится из крови, попадает в костный мозг и ретикулоэндотелиальной системы печени и селезенки.
Метаболизм
Карбоксимальтозне железо главным образом поглощается ретикулоэндотелиальной системой печени, костного мозга и в незначительной степени селезенкой и распадается на гидроксид железа и углеводы, причем железо связывается, формируя ферритин. Железо становится доступным для эритропоэза через трансферрин, если это необходимо. Углеводные продукты распада представляют собой мальтотетраозу, мальтотриозу, мальтозу и глюкозу.
Элиминация
Плазматический клиренс введенного железа быстрый, с конечным периодом полувыведения от 7 до 12 часов и средним временем удержания препарата от 11 до 18 часов. Выведение железа почками было незначительным.
Кинетика у особых групп пациентов
Дети в возрасте 1-17 лет
Фармакокинетику введенной внутривенно карбоксимальтозы железа исследовали у детей в возрасте от 1 года с железодефицитной анемией в фармакокинетическом/фармакодинамическом исследовании фазы 2 1VIT13036 с применением одноразовых доз, что было дополнено популяционным фармакокинетическим анализом, который включал дополнительные выборочные фармакокинетические образцы из клинического исследования фазы 3 1VIT17044. Фармакокинетические свойства при уровне дозы 15 мг железа/кг (максимальная однократная доза составляет 750 мг) были подобны таковым у взрослых пациентов с дефицитом железа, которые получали рекомендованную дозу для взрослых. Уровень железа в сыворотке крови повышался пропорционально дозе при применении одноразовых доз 7,5 мг железа/кг и 15 мг железа/кг. После введения однократной дозы лекарственного средства Феринжект® 15 мг железа/кг массы тела (максимальная доза составляет 750 мг) средний максимальный уровень общего железа в сыворотке крови 310 мкг/мл определялся через 1,12 часа. Конечный период полувыведения составлял 9,8 часа, а объем распределения, рассчитанный по данным популяционного фармакокинетического анализа, составлял от 0,42 до 3,14 л.
Нарушение функции печени
Исследования с участием пациентов с печеночной недостаточностью не проводились.
Показания
Применение препарата показано пациентам в случае недостаточной эффективности, неэффективности или невозможности перорального приема железосодержащих препаратов, например, в связи с непереносимостью пероральных препаратов железа или при наличии заболеваний желудочно-кишечного тракта (таких как язвенный колит), когда пероральные препараты железа могут спровоцировать обострение болезни, или при условии резистентного к терапии железодефицитного состояния, когда есть подозрение, что препараты железа не применяются должным образом.
Противопоказания
Гиперчувствительность к активному веществу или другим компонентам препарата;
анемия без подтвержденного дефицита железа;
наличие признаков перенасыщения организма железом;
І триместр беременности.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействия
Препарат не следует применять одновременно с железосодержащими пероральными средствами, поскольку абсорбция железа, применяемого внутрь, снижается (см. раздел «Особенности применения»).
Особенности по применению
Феринжект® следует применять только тогда, когда диагноз железодефицитного состояния установлен и подтвержден соответствующими лабораторными исследованиями (например, определение уровня таких показателей, как уровень ферритина в плазме крови, насыщение трансферрина (TSAT), гемоглобин (Hb), гематокрит, количество эритроцитов, средний объем эритроцитов (MCV) и среднее содержание гемоглобина в эритроцитах (MCH)).
Реакции гиперчувствительности
Внутривенное применение препаратов железа может привести к возникновению реакций гиперчувствительности немедленного типа (анафилактических реакций), которые могут быть летальными.
Сообщалось о возникновении таких реакций даже в случаях, когда предыдущее применение препаратов железа для парентерального введения проходило без осложнений. Поступали сообщения о реакции гиперчувствительности, которые могли прогрессировать до синдрома Коуниса (острый аллергический спазм коронарных артерий, что может привести к инфаркту миокарда, см. раздел «Побочные реакции»). Лечение препаратом Феринжект® должен назначать дежурный врач только после точного определения показаний.
Феринжект® можно вводить только при условии, что медицинский персонал, имеющий навыки оценки и лечения анафилактических реакций, готов к немедленным действиям, и при наличии помещения, должным образом оборудованного средствами для проведения реанимационных мероприятий. Перед каждым применением препарата Феринжект® следует опросить пациента относительно предыдущего возникновения побочных реакций, связанных с применением препаратов железа для внутривенного введения.
Типичными симптомами острых реакций гиперчувствительности являются снижение артериального давления, тахикардия (даже анафилактический шок), респираторные симптомы (включая бронхоспазм, отек гортани и фарингеальный отек), симптомы со стороны желудочно-кишечного тракта (включая абдоминальные спазмы, рвота) или симптомы со стороны кожи (включая крапивницу, эритему, зуд).
Состояние каждого пациента следует тщательно контролировать относительно любых проявлений реакций гиперчувствительности в течение введения и по меньшей мере через 30 минут после каждого парентерального введения железосодержащих препаратов. При возникновении любых аллергических реакций или признаков непереносимости во время введения препарата лечение следует немедленно прекратить.
Для экстренной терапии острых анафилактических реакций рекомендуется прежде всего адреналин, согласно современным руководствам для оказания неотложной помощи и информации производителя лекарственного средства, и только потом - антигистаминные препараты и/или кортикостероиды (имеют более позднее начало действия).
Редко наблюдалась лихорадка или замедленные аллергические реакции (с задержкой на несколько часов или даже дней).
Риск возникновения реакций гиперчувствительности выше у пациентов с имеющейся аллергией, включая непереносимость лекарственных средств, тяжелое течение бронхиальной астмы в анамнезе, экземой и другими формами аллергии, а также у пациентов с иммунологическими и воспалительными заболеваниями (например, системная красная волчанка, ревматоидный артрит).
Гипофосфатемия/гипофосфатемическая остеомаляция
Применение парентеральных препаратов железа может вызвать гипофосфатемию, что в большинстве случаев является временной и протекает без клинических симптомов. Сообщали об отдельных случаях гипофосфатемии, которая требовала медицинской помощи, главным образом у пациентов с факторами риска и после длительного применения более высоких доз.
В послерегистрационный период сообщали о случаях гипофосфатемии с клиническими проявлениями, что приводила к гипофосфатемической остеомаляции и переломов, которые требовали клинического вмешательства, в том числе хирургического вмешательства. Пациентов следует информировать о необходимости обращения к врачу в случае появления артралгии или боли в костях.
За пациентами, которые получают многократные повышенные дозы в рамках длительного лечения и которые имеют факторы риска (например дефицит витамина D, нарушение всасывания кальция и фосфатов, вторичный гиперпаратиреоз, наследственная геморрагическая телеангиэктазия, воспалительное заболевание кишечника и остеопороз), следует наблюдать относительно возникновения гипофосфатемической остеомаляции, включая контроль сывороточного уровня фосфатов. В случае стойкой гипофосфатемии лечение препаратом Феринжект® следует пересмотреть.
Печеночная или почечная недостаточность
Пациентам с нарушениями функции печени препараты железа для парентерального введения следует применять после тщательной оценки соотношения польза/риск.
Следует избегать парентерального введения железа пациентам с нарушениями функции печени, причиной которой является перенасыщение железом, особенно в случаях поздней кожной порфирии, и при любом остром нарушении со стороны печени.
Необходимо тщательно контролировать уровень железа во избежание перенасыщения железом.
Инфекции
Железо для парентерального введения применяют с осторожностью пациентам с острой или хронической инфекцией, бронхиальной астмой, экземой или атопической аллергией. Рекомендовано прекратить лечение препаратом Феринжект® пациентам с продолжающейся бактериемией.
Экстравазация
Следует избегать паравенозных утечек. Это может вызвать раздражение кожи и долговременное окрашивание места инъекции/инфузии в коричневый цвет. В случае паравенозного вытекания лекарственного средства Феринжект® следует немедленно прекратить его введение.
Другие компоненты
1 мл препарата Феринжект® может содержать до 5,5 мг (0,24 ммоль) натрия. Это необходимо учитывать пациентам, которые придерживаются диеты с контролем натрия.
Применение в период беременности и кормления грудью
Беременность. На сегодня есть ограниченное количество данных контролируемых клинических исследований по применению препарата Феринжект® беременным женщинам. Исследования на животных свидетельствуют о репродуктивной токсичности. Следует оценивать соотношение риск/польза перед применением препарата в течение периода беременности, поскольку реакции гиперчувствительности могут нести особый риск для матери и ребенка (см. раздел «Особенности применения»).
Препарат Феринжект® противопоказано применять в I триместре беременности (см. раздел «Противопоказания»). Возможно применение препарата во II и III триместрах беременности только строго по показаниям. При применении препарата во II и III триместрах беременности следует учитывать данные по массе тела до начала беременности для расчета необходимого количества железа, чтобы избежать передозировки. При применении в период беременности особое внимание следует уделять выявлению признаков реакций гиперчувствительности.
После введения парентеральных препаратов железа может возникнуть брадикардия плода, что обычно имеет транзиторный характер и является следствием реакции гиперчувствительности у матери. Во время внутривенного введения парентеральных препаратов железа беременным следует тщательно контролировать состояние нерожденного ребенка.
Кормление грудью. Существует небольшой клинический опыт применения препарата во время кормления грудью. Клиническое исследование показало, что попадание железа из лекарственного средства Феринжект® в грудное молоко очень мало (≤ 1 %). Следовательно, маловероятно, что применение лекарственного средства Феринжект® будет представлять риск для ребенка на грудном вскармливании.
Фертильность. Клинических данных о влиянии препарата Феринжект® на фертильность нет. В исследованиях на животных применение лекарственного средства Феринжект® не выявило никакого влияния на фертильность.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Соответствующие исследования отсутствуют. Влияние на скорость реакции при управлении автотранспортом или другими механизмами маловероятно.
Способ применения и дозы
Во время и после каждого введения лекарственного средства Феринжект® следует наблюдать за состоянием пациентов относительно возникновения признаков и симптомов реакций гиперчувствительности.
Феринжект® можно вводить только при условии, что медицинский персонал, имеющий опыт оценки и лечения анафилактических реакций, готов к немедленным действиям, и при наличии помещения, должным образом оборудованного средствами для проведения кардиореспираторных реанимационных мероприятий. За состоянием пациентов следует наблюдать относительно проявлений побочных реакций по меньшей мере в течение 30 минут после каждого введения лекарственного средства Феринжект® (см. раздел «Особенности применения»).
Взрослые
Дозировка
Дозировка лекарственного средства Феринжект® проводится в несколько этапов: [1] определение индивидуальной потребности в железе, [2] расчет и введение доз железа и [3] проверка запасов железа после пополнения.
Шаг 1. Расчет необходимого количества железа
Индивидуальное количество железа, необходимое для пополнения запасов железа с применением лекарственного средства Феринжект®, можно определить на основе массы тела пациента и уровня гемоглобина (Hb). Потребность в железе следует определять по формуле Ганзони (см. таблицу 1) или по упрощенной схеме дозирования (см. таблицу 2).
Использование формулы Ганзони рекомендуется для пациентов, которым нужна доза, адаптированная к их индивидуальным потребностям, например пациентам с нервной анорексией, кахексией, ожирением или беременным женщинам. Дефицит железа должен быть подтвержден лабораторными исследованиями (см. раздел «Особенности применения»).
Таблица 1
Определение потребности в железе по формуле Ганзони
| Масса тела | Hb (г/дл) | |||
| [кг] | 6 | 7,5 | 9 | 10,5 |
| 30 | 18 мл (900 мг) | 16 мл (800 мг) | 14 мл (700 мг) | 12 мл (600 мг) |
| 35 | 24 мл (1200 мг) | 22 мл (1100 мг) | 20 мл (1000 мг) | 16 мл (800 мг) |
| 40 | 26 мл (1300 мг) | 24 мл (1200 мг) | 20 мл (1000 мг) | 18 мл (900 мг) |
| 45 | 28 мл (1400 мг) | 26 мл (1300 мг) | 22 мл (1100 мг) | 18 мл (900 мг) |
| 50 | 30 мл (1500 мг) | 28 мл (1400 мг) | 24 мл (1200 мг) | 20 мл (1000 мг) |
| 55 | 32 мл (1600 мг) | 28 мл (1400 мг) | 24 мл (1200 мг) | 20 мл (1000 мг) |
| 60 | 34 мл (1700 мг) | 30 мл (1500 мг) | 26 мл (1300 мг) | 22 мл (1100 мг) |
| 65 | 38 мл (1900 мг) | 32 мл (1600 мг) | 28 мл (1400 мг) | 24 мл (1200 мг) |
| 70 | 42 мл (2100 мг) | 36 мл (1800 мг) | 32 мл (1600 мг) | 26 мл (1300 мг) |
| 75 | 44 мл (2200 мг) | 38 мл (1900 мг) | 32 мл (1600 мг) | 28 мл (1400 мг) |
| 80 | 46 мл (2300 мг) | 40 мл (2000 мг) | 34 мл (1700 мг) | 28 мл (1400 мг) |
| 85 | 48 мл (2400 мг) | 42 мл (2100 мг) | 36 мл (1800 мг) | 30 мл (1500 мг) |
| 90 | 50 мл (2500 мг) | 44 мл (2200 мг) | 36 мл (1800 мг) | 30 мл (1500 мг) |
Hb - гемоглобин
При массе тела ≤ 66 кг рассчитанную общую кумулятивную дозу следует округлить в меньшую сторону до ближайших 100 мг железа.
При массе тела > 66 рассчитанную общую кумулятивную дозу следует округлить в большую сторону до ближайших 100 мг железа.
Формула Ганзони:
|
Общий дефицит железа [мг] = общая кумулятивная доза [мг] = Масса тела(A) [кг] × (целевой уровень Hb(B) - фактический уровень Hb)(C) [г/дл] × 2,4(D) + депонированное железо(E) [мг]. |
(A) Для пациентов с избыточной массой тела рекомендуется использовать идеальную массу тела, для беременных - массу тела до беременности. Есть разные способы определения идеальной массы тела, например расчет массы тела, соответствующей индексу массы тела (ИМТ) 25: идеальная масса тела = 25*(рост в метрах)2.
(B) Стандартный целевой уровень гемоглобина для формулы Ганзони составляет 15 г/дл. В особых случаях, например для беременных, следует устанавливать более низкий целевой уровень гемоглобина.
Эффективность лечения следует контролировать по результатам анализов крови. Для достижения целевого уровня гемоглобина может потребоваться корректировка кумулятивной дозы железа.
(C) Для пересчета гемоглобина в ммоль/л на г/дл следует умножить показатель гемоглобина в ммоль/л на коэффициент 1,61145.
(D) Коэффициент 2,4 = 0,0034 × 0,07 × 10 000.
0,0034: содержание железа в гемоглобине составляет 0,34 %.
0,07: объем крови 70 мл/кг массы тела ≈ 7 % от массы тела.
10 000: коэффициент для перевода «г/дл» в «мг/д» (1 г/дл = 10 000 мг/л).
(E) Для пациентов с массой тела > 35 кг количество депонированного железа составляет 500 мг или более. Величина депонированного железа 500 мг соответствует нижней границе нормы для женщин с низкими антропометрическими характеристиками («миниатюрные женщины»). Некоторые руководства рекомендуют определять депонированное железо из расчета 10-15 мг железа/кг массы тела.
Таблица 2
Определение потребности в железе по упрощенной схеме дозирования
| гематокрит | Масса тела пациента | |||
| г/дл | ммоль/л | < 35 кг | 35 кг - < 70 кг | ≥ 70 кг |
| < 10 | < 6,2 | 500 мг | 1500 мг | 2000 мг |
| 10 - < 14 | 6,2 - < 8,7 | 500 мг | 1000 мг | 1500 мг |
| ≥ 14 | ≥ 8,7 | 500 мг | 500 мг | 500 мг |
Шаг 2. Расчет и введение максимальной дозы железа
Феринжект® следует вводить в соответствующих дозах в зависимости от определенного необходимого количества железа. Применять, как описано ниже.
Одноразовая доза лекарственного средства Феринжект® не должна превышать такие величины:
15 мг железа/кг массы тела (при введении путем внутривенной инъекции) или
20 мг железа/кг массы тела (при введении путем внутривенной инфузии), или
1000 мг железа (20 мл лекарственного средства Феринжект®).
Максимальная рекомендуемая кумулятивная доза лекарственного средства Феринжект® составляет 1000 мг железа (20 мл лекарственного средства Феринжект®) в неделю. Если кумулятивная доза железа превышает 20 мг железа/кг массы тела или 1000 мг железа в лекарственном средстве Феринжект®, дозу следует разделить на два введения с интервалом не менее 1 недели.
Шаг 3. Проверка запасов железа после пополнения
В зависимости от состояния конкретного пациента врачу следует проводить повторные обследования (включая анализы крови). Уровень гемоглобина следует повторно определять не ранее чем через 4 недели после последнего введения лекарственного средства Феринжект®, чтобы было достаточно времени для эритропоэза и утилизации железа. Если пациент нуждается в дальнейшем пополнении запасов железа, потребность в железе следует пересчитать по формуле Ганзони или по упрощенной схеме дозирования.
Способ введения
Феринжект® вводят исключительно внутривенно:
путем инъекции или
путем инфузии, или
в неразведенном виде путем инъекции непосредственно в венозную часть диализатора во время процедуры гемодиализа.
Феринжект® нельзя вводить внутримышечно или подкожно.
Во время и после применения препарата Феринжект® следует наблюдать за состоянием пациентов относительно возникновения симптомов гиперчувствительности. Необходимо обеспечить проведение соответствующей неотложной терапии (см. раздел «Особенности применения»).
Внутривенная инъекция
Феринжект® может быть введен путем внутривенной инъекции неразведенного раствора. Максимальная допустимая однократная доза составляет 15 мг железа/кг массы тела и не должна превышать 1000 мг железа. Скорость введения см. в таблице 3.
Таблица 3
Скорость введения для внутривенной инъекции лекарственного средства Феринжект®
| Необходимый объем лекарственного средства Феринжект® | Эквивалентная доза железа | Скорость введения/ минимальное время введения | ||||
| 2 | до | 4 мл | 100 | до | 200 мг | Нет требования относительно минимального времени введения |
| > 4 | до | 10 мл | > 200 | до | 500 мг | 100 мг железа/минуту |
| > 10 | до | 20 мл | > 500 | до | 1000 мг | 15 минут |
Внутривенная инфузия
Феринжект® может быть введен путем внутривенной инфузии, и в этом случае его необходимо разводить. Максимальная допустимая однократная доза составляет 20 мг железа/кг массы тела и не должна превышать 1000 мг железа. Для инфузий лекарственное средство Феринжект® следует разводить только стерильным 0,9 % (м/об) раствором натрия хлорида, как показано в таблице 4. Примечание: для обеспечения стабильности не допускается разведение лекарственного средства Феринжект® до концентрации менее 2 мг железа/мл (не учитывая объем раствора железа карбоксимальтозы во флаконе). Дополнительно по разведению этого лекарственного средства перед введением см. ниже «Инструкции по обращению».
Таблица 4
План разведения лекарственного средства Феринжект® для внутривенной инфузии
| Необходимый объем лекарственного средства Феринжект® | Эквивалентная доза железа | Максимальный объем стерильного 0,9 % (м/об) раствора натрия хлорида | Минимальное время введения | ||||
| 2 | до | 4 мл | 100 | до | 200 мг | 50 мл | Нет требования относительно минимального времени введения |
| > 4 | до | 10 мл | > 200 | до | 500 мг | 100 мл | 6 минут |
| > 10 | до | 20 мл | > 500 | до | 1000 мг | 250 мл | 15 минут |
Инструкции по обращению
Флаконы предназначены только для одноразового использования.
Перед применением препарата необходимо визуально проверить флаконы на наличие видимых частиц и повреждений.
Следует использовать только флаконы с однородным раствором без видимых частиц.
Феринжект® можно смешивать только со стерильным 0,9% (м/об) раствором натрия хлорида. Другие внутривенные растворы для разведения и лекарственные средства нельзя использовать из-за риска образования осадка и/или взаимодействия.
Особые группы пациентов
Дети в возрасте до 1 года
Эффективность и безопасность применения лекарственного средства Феринжект® детям в возрасте до 1 года не исследовались, поэтому не рекомендуется применять лекарственное средство детям этой возрастной категории.
Дети в возрасте ≥ 1 года
Лекарственное средство Феринжект® не одобрено для применения детям в возрасте от 1 до 18 лет из-за ограниченности данных.
Рекомендации по дозировке не могут быть предоставлены. Имеющиеся на сегодня данные по применению детям описаны в разделах «Фармакологические свойства» и «Побочные реакции».
Пациенты с хроническим заболеванием почек, нуждающихся в гемодиализе
Для пациентов с хроническими заболеваниями почек, нуждающихся в гемодиализе, максимальная вводимая доза не должна превышать 200 мг железа 1 раз в сутки.
Эффективность и безопасность применения лекарственного средства Феринжект® детям с хроническими заболеваниями почек, нуждающихся в гемодиализе, не исследовались. Поэтому не рекомендуется применять лекарственное средство Феринжект® детям с хроническими заболеваниями почек, которые нуждаются в гемодиализе.
Пациенты с нарушениями со стороны печени
Отсутствует опыт применения лекарственного средства Феринжект® пациентам с нарушениями функции печени.
Дети
Эффективность и безопасность применения препарата Феринжект® детям не исследовались, поэтому не рекомендуется применять препарат пациентам этой возрастной категории. Имеющиеся на сегодня данные по применению детям описаны в разделах «Фармакологические свойства» и «Побочные реакции».
Передозировка
Случайное превышение общей кумулятивной дозы, необходимой для коррекции дефицита железа у пациента, может привести к накоплению железа в его запасах и в конечном итоге - к гемосидерозу у таких пациентов. Это можно предотвратить путем профилактического контроля параметров железа - сывороточного ферритина и насыщения трансферрина. Нежелательное накопление железа следует лечить в соответствии со стандартной медицинской практикой.
Побочные эффекты
О приведенных ниже побочных реакциях сообщали в клинических исследованиях с участием 9456 взрослых пациентов и 82 детей в возрасте ≥ 1 года, которым применяли лекарственное средство Феринжект®, а также во время постмаркетингового применения.
Нежелательные эффекты по частоте возникновения классифицируют по таким категориям: часто (< 1/10 - ≥ 1/100), нечасто (< 1/100 - ≥ 1/1000), редко (< 1/1000 - ≥ 1/10 000) и неизвестно (нельзя оценить на основе имеющихся данных). К наиболее частым нежелательным реакциям относятся тошнота, реакция в месте инъекции/инфузии, гипофосфатемия, головная боль, гиперемия лица, головокружение, артериальная гипертензия.
К наиболее важным серьезным побочным реакциям, возникновение которых ассоциировалось с применением препарата Феринжект®, относятся реакции гиперчувствительности, которые являются нечастыми (см. ниже реакции со стороны иммунной системы).
Наиболее серьезными побочными реакциями были анафилактические реакции (редко): сообщали о летальных случаях.
В клинических исследованиях у пациентов с выявленным снижением сывороточных уровней фосфатов самые низкие показатели определялись примерно через 2 недели. В большинстве случаев показатели нормализовались до исходных значений в течение 12 недель после лечения препаратом Феринжект®.
Профиль безопасности у детей в возрасте 1-17 лет изучали в приведенных ниже исследованиях.
В проспективном фармакокинетическом/фармакодинамическом исследовании фазы 2 (1VIT13036) 35 детей в группах с последовательным введением доз получали лечение путем внутривенного введения одноразовых доз лекарственного средства Феринжект® 7,5 мг железа/кг (n = 16) и Феринжект® 15 мг железа/кг (n = 19) (максимальная доза составляет 750 мг железа). Не наблюдалось неожиданных побочных реакций на лекарственное средство по сравнению со взрослыми. Наиболее частыми побочными реакциями были по 2 случая пирексии и сыпи при применении лекарственного средства Феринжект® в дозе 7,5 мг железа/кг и по 3 случая ринореи и крапивницы, а также по 2 случая пирексии и инфекции верхних дыхательных путей при применении лекарственного средства Феринжект® в дозе 15 мг железа/кг.
В проспективном открытом исследовании с параллельными группами фазы 3 (1VIT17044) 40 детей получали 2 дозы лекарственного средства Феринжект® по 15 мг железа/кг каждая с интервалом 7 дней (максимальная однократная доза составляет 750 мг). Не наблюдалось неожиданных побочных реакций на лекарственное средство по сравнению со взрослыми. Наиболее частыми побочными реакциями после внутривенной терапии лекарственным средством Феринжект® были гипофосфатемия/снижение уровня фосфатов в сыворотке крови (n = 5), рвота (n = 2), головная боль (n = 2) и крапивница (n = 2).
При лабораторном биохимическом исследовании выявлено потенциально клинически значимую гипофосфатемию у 8 пациентов, которые применяли лекарственное средство Феринжект® (в том числе 4 из зарегистрированных случаев побочных реакций). Самый низкий уровень фосфатов обычно определялся через 2 недели после начала терапии и в основном нормализовался на 35-й день после начала лечения. Все случаи гипофосфатемии были бессимптомными.
См. также раздел «Особенности применения».
Со стороны иммунной системы
Нечасто: реакции гиперчувствительности немедленного типа (анафилактическая реакция) могут привести к летальному исходу (см. раздел «Особенности применения»). Симптомы анафилактических реакций включают циркуляторный коллапс, артериальную гипотензию, тахикардию, респираторные симптомы (бронхоспазм, отек гортани, фарингеальный отек), симптомы со стороны желудочно-кишечного тракта (абдоминальные спазмы, рвота), симптомы со стороны кожи (крапивница, эритема, зуд).
Метаболизм и нарушение питания
Часто: гипофосфатемия (на основе лабораторных данных).
Со стороны психики
Редко: ощущение тревоги.
Со стороны нервной системы
Часто: головная боль, головокружение.
Нечасто: искажение вкуса (дисгевзия), парестезия.
Неизвестно: потеря сознания.
Со стороны сердца
Нечасто: тахикардия.
Со стороны сосудистой системы
Часто: артериальная гипертензия, приливы.
Нечасто: артериальная гипотензия.
Редко: головокружение, потеря сознания, флебит.
Со стороны дыхательной системы, органов грудной клетки и средостения
Нечасто: одышка.
Редко: бронхоспазм.
Со стороны пищеварительной системы
Часто: тошнота.
Нечасто: абдоминальная боль, рвота, запор, диарея, диспепсия.
Редко: метеоризм.
Со стороны печени и желчного пузыря
Нечасто: повышение уровня аланинаминотрансферазы (АлАТ), повышение уровня аспартатаминотрансферазы (АсАТ), повышение уровня гамма-глутамилтрансферазы (γ-ГТ), повышение уровня щелочной фосфатазы (ЩФ), повышение уровня лактатдегидрогеназы (ЛДГ).
Со стороны кожи и подкожных тканей
Нечасто: высыпания (включает такие реакции: эритематозная, генерализованная, макулезная, макулопапулезная, зудящая сыпь), зуд, крапивница, эритема.
Редко: ангионевротический отек, отдаленное обесцвечивание кожи, бледность.
Неизвестно: дерматит, отек лица.
Со стороны костно-мышечной системы и соединительной ткани
Нечасто: артралгия, миалгия, боль в конечностях, боль в спине, мышечные спазмы.
Неизвестно: гипофосфатемическая остеомаляция.
Общие нарушения и реакции в месте введения
Часто: реакции в месте инъекции/инфузии (включая такие симптомы, как боль, гематома, изменение цвета (потенциально длительная), экстравазация, раздражение, флебит и парестезия в месте инъекции/инфузии).
Нечасто: пирексия, утомляемость, озноб, боль в груди, периферический отек, боль, недомогание.
Редко: гриппоподобные заболевания (с началом в период от нескольких часов до нескольких дней).
Сообщения о подозреваемых побочных реакциях
Сообщение о побочных реакциях после регистрации лекарственного средства имеет важное значение. Это позволяет проводить мониторинг соотношения польза/риск при применении этого лекарственного средства. Медицинским и фармацевтическим работникам, а также пациентам или их законным представителям следует сообщать обо всех случаях подозреваемых побочных реакций и отсутствия эффективности лекарственного средства через автоматизированную информационную систему по фармаконадзору по ссылке: https://aisf.dec.gov.ua.
Срок годности
3 года.
Условия хранения
Хранить в оригинальной упаковке при температуре не выше 30 ºС. Не замораживать. Хранить в недоступном для детей месте!
Несовместимость
Феринжект® можно смешивать только со стерильным 0,9% раствором натрия хлорида. Совместимость с контейнерами, изготовленными из материалов, кроме полиэтилена и стекла, не изучена.
Упаковка
По 2 мл или 10 мл во флаконе; по 1 или 5 флаконов в картонной коробке.
Категория отпуска
По рецепту.
Производитель
Вифор (Интернешнл) Инк., Швейцария/Vifor (International) Inc., Switzerland.
Местонахождение производителя и адрес места осуществления его деятельности;
Рехенштрассе 37, 9014 В. Галлен, Швейцария/Rechenstrasse 37, 9014 St. Gallen, Switzerland.
Часто задаваемые вопросы
Какая цена на Феринжект раствор для инъекций 50 мг/мл 10 мл №1?
В чем особенности товара Феринжект раствор для инъекций 50 мг/мл 10 мл №1?
Какие действующие вещества у Феринжект раствор для инъекций 50 мг/мл 10 мл №1?
Какие отзывы у товара Феринжект раствор для инъекций 50 мг/мл 10 мл №1?
Доброго дня) Я якраз роздумовую, чи йти на крапельницю чи краще не ризикувати і пити пігулки. Підкажіть як ви? Я маю гемоглобін в нормі, а от феритин 8, і його насичення в мінусах.
Отзывы покупателей о Феринжект раствор для инъекций 50 мг/мл 10 мл №1
Зменшився вміст заліза в організмі, і доволі сильно. Пігулки не допомагали, сказали треба тоді уколи. Прописали Феринжект. Допоміг.
Был низкий Ферритин,прокапала сегодня феринжект,очень боялась побочных реакций и анафилактического шока ,как начиталась по инструкции ,что бывает ,но слава Богу ничего такого не было! Эффект отличный после капельницы: бодрость появилась ,слабость практически ушла, вообще силы появились ! Голова как-то посветлела ! посмотрим как будет в дальнейшем! Рекомендую этот препарат