Евра пластырь ТТС №3
Основные свойства
Характеристики
| Торговое название | Евра |
| Действующее вещество | Этинилэстрадиол, Норэльгестромин |
| Взрослым | Можно |
| Способ введения | Прочие системные |
| Детям | Нельзя |
| Количество в упаковке | 3 шт |
| Беременным | Нельзя |
| Кормящим | Нельзя |
| Аллергикам | С осторожностью |
| Производитель | Johnson & Johnson |
| Диабетикам | С осторожностью |
| Страна производства | Бельгия |
| Водителям | Можно |
| Форма | Трансдермальные пластыри |
| Условия отпуска | По рецепту |
| Код ATC | G03A A13 Норэльгестромин и этинилэстрадиол |
Инструкция Евра пластырь ТТС №3
Состав
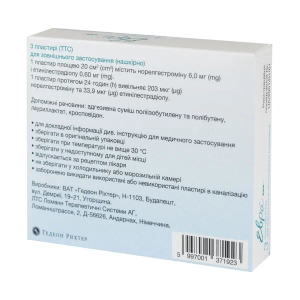
действующие вещества: 1 пластырь площадью 20 см2 содержит норэлгестромина 6,0 мг, этинилэстрадиола 0,60 мг; каждый пластырь в течение 24 часов высвобождает 203 мкг норэлгестромина и 33,9 мкг этинилэстрадиола;
вспомогательные вещества: адгезивная смесь полиизобутилена и полибутена, лауриллактат, кросповидон.
Лекарственная форма
Пластырь - трансдермальная терапевтическая система (ТТС).
Основные физико-химические свойства: квадратная трансдермальная система с матовой основой телесного цвета, закругленными углами, прозрачной пленкой, которая удаляется, и бесцветным клеевым (адгезивным) слоем. Система упакована в непрозрачный белый пакет, на который нанесена соответствующая маркировка.
Фармакотерапевтическая группа
Гормональные контрацептивы для системного применения.
Код АТХ G0ЗА А13.
Фармакологические свойства
Фармакодинамика.
Эвра®-контрацептив, предотвращающий оплодотворение благодаря механизму угнетения гонадотропинов путем эстрогенного и прогестагенного действия этинилэстрадиола и норэлгестромина. Первичный механизм действия заключается в ингибировании овуляции, но изменения цервикальной слизи и эндометрия также могут усиливать эффективность препарата.
Таблица 1
Индексы Перля
| Исследуемая группа |
СОNT-002 Евра® |
СОNT-003 Евра® |
СОNT-002 КПК* |
СОНТ-002 Евра® |
СОNT-002 КПК** |
Все пациенты Эвра® |
| Количество циклов | 10743 | 5831 | 4592 | 5095 | 4005 | 21669 |
|
Индекс Перля (ДИ 95 %) Общий |
0,73 (0,15-1,31) |
0,89 (0,02-1,76) |
0,57 (0,0-1,35) |
1,28 (0,16-2,39) |
2,27 (0,59-3,96) |
0,90 (0,44-1,35) |
|
Индекс Перля (ДИ 95 %) Ошибка метода |
0,61 (0,0-1,14) |
0,67 (0,0-1,42) |
0,28 (0,0-0,84) |
1,02 (0,02-2,02) |
1,30 (0,03-2,57) |
0,72 (0,31-1,13) |
* Дезогестрел 150 мкг + этинилэстрадиол (ЭЭ) 20 мкг.
** Левоноргестрел 50 мкг + ЭЭ 30 мкг 1-6 дни, левоноргестрел 75 мкг + ЭЭ 40 мкг 7-11 дни, левоноргестрел 125 мкг + ЭЭ 30 мкг 12-21 дни.
Для определения, связаны ли с беременностью популяционные характеристики возраста, расы и массы тела, были проведены исследовательские анализы в исследованиях III фазы (n = 3319). Анализы не показали никакой связи возраста и расы пациентки с беременностью. Относительно массы тела, то 5 из 15 беременностей, о которых сообщалось при применении препарата Эвра®, были у женщин, начальная масса тела которых равнялась или превышала 90 кг, что составляло < 3 % исследуемой популяции. При массе тела менее 90 кг связи между массой тела и беременностью не было. Хотя лишь 10-20% вариабельности фармакокинетических данных можно объяснить массой тела (см. раздел «Фармакокинетика»), большая доля беременностей у женщин с массой тела 90 кг или более была статистически значимой, что указывает на то, что Эвра® менее эффективен у этих женщин.
При применении более высоких доз КПК (50 мкг этинилэстрадиола) снижается риск рака эндометрия и яичников. Или это также касается комбинированных гормональных контрацептивов с меньшей дозой, еще предстоит подтвердить.
Фармакокинетика.
Абсорбция. Равновесная концентрация (плато) норэлгестромина и этинилэстрадиола в сыворотке крови достигается примерно через 48 часов после аппликации пластыря (ТТС) Эвра®. Стабильный уровень концентрации норэлгестромина и этинилэстрадиола в течение 1 недели применения пластыря составляет почти 0,8 нг/мл и 50 пг/мл соответственно. В исследованиях многократных доз трансдермального пластыря (ТТС) Эвра® сывороточные концентрации (Css) и AUC незначительно увеличиваются относительно концентраций на 1-й неделе 1-го цикла.
Абсорбция норэлгестомина и этинилэстрадиола после наклеивания пластыря (ТТС) Эвра® исследовались в условиях спортивного клуба (сауна, джакузи, беговая дорожка и другие упражнения по аэробике), а также в ванне с холодной водой. Результаты свидетельствовали, что для норэлгестромина не было существенных изменений в Css и AUC по сравнению с таковыми при обычном образе жизни. Для этинилэстрадиола эти значения несколько увеличивались при физической нагрузке; однако уровень Css был в пределах референтных значений. Холодная вода не влияла на эти параметры.
Результаты исследования применения одного контрацептивного трансдермального пластыря (ТТС) Евра® в течение 7 дней и 10 дней показали, что целевые значения Css норелгестроміну и этинилэстрадиола поддерживались в течение 3 дней продленного применения пластыря (ТТС) Евра® (10 дней), то есть клиническая эффективность ТТС сохраняется, даже если женщина проведет очередную замену пластыря (ТТС) Евра® на 2 полных дня позже запланированного срока.
Распределение. Норэлгестромин и норгестрел (сывороточный метаболит норэлгестромина) имеют высокую степень (> 97 %) связывания с белками сыворотки крови. Норэлгестромин связывается с альбумином, норгестрел - преимущественно с глобулинами, связывающими половые гормоны. Этинилэстрадиол имеет высокую степень связывания с сывороточным альбумином.
Биотрансформация. Норелгестромин метаболизируется в печени с образованием метаболита норгестрела, что преимущественно связывается с глобулином, связывающим половые гормоны (ГЗСГ), а также различных гидроксилированных и конъюгированных метаболитов. Этинилэстрадиол метаболизируется до различных гидроксилированных продуктов и их глюкуронидов и сульфатных конъюгатов.
Элиминация. После снятия пластыря средний период полувыведения норэлгестромина и этинилэстрадиола составляет почти 28 часов и 17 часов соответственно. Метаболиты норэлгестромина и этинилэстрадиола элиминируются с мочой и калом.
Трансдермальные и пероральные контрацептивные средства. Фармакокинетические профили трансдермальных и пероральных комбинированных контрацептивов разные, и следует соблюдать осторожность при методе прямого сопоставления фармакокинетических параметров. В ходе сравнения пластыря (ТТС) Эвра® и пероральных контрацептивов, содержащих норгестимат (предшественник норэлгестромина) 250 мкг/этинилэстрадиол 35 мкг, значения Смах были в 2 раза выше для НГМН и ЭЭ у испытуемых, принимавших пероральные контрацептивы, по сравнению с соответствующими показателями в группе Евра®, тогда как общая экспозиция (AUC и Css) были подобными у испытуемых, которые применяли пластырь (ТТС) Евра®. Межсубъектная вариабельность (% СѴ) для фармакокинетических параметров доставки норэлгестромина и этинилэстрадиола от пластыря (ТТС) Эвра® была выше относительно вариабельности, установленной от пероральных контрацептивов.
Влияние возраста, массы тела и площади поверхности тела
Влияние возраста, массы тела и площади поверхности тела на фармакокинетику норэлгестромина и этинилэстрадиола изучали с участием 230 женщин в ходе 9 фармакокинетических исследований разового 7-дневного применения пластыря (ТТС) Евра®. Значения Css и AUC норэлгестромина и этинилэстрадиола незначительно снижаются с увеличением возраста, массы тела и площади поверхности тела. Однако лишь малая часть (10-20 %) общей вариабельности фармакокинетики норэлгестромина и этинилэстрадиола после применения пластыря (ТТС) Евра® может быть связана с одним из вышеупомянутых параметров.
Показания
Контрацепция у женщин.
Эвра® показан к применению женщинам репродуктивного возраста. Безопасность и эффективность пластыря ТТС Эвра® установлены только для женщин в возрасте от 18 до 45 лет.
Решение о назначении препарата Евра® должно учитывать текущие факторы риска для каждой женщины, особенно в отношении венозной тромбоэмболии (ВТЭ), с учетом риска венозной тромбоэмболии (ВТЭ) при применении Евра® по сравнению с другими комбинированными гормональными контрацептивами (КГК) (см. разделы «Противопоказания», «Особенности применения»).
Противопоказания
Комбинированные гормональные контрацептивы (КГК) нельзя применять при наличии одного из следующих состояний. Если любое из этих состояний возникает во время применения лекарственного средства Эвра®, его применение следует немедленно прекратить.
Венозная тромбоэмболия (ВТЭ) или риск ее развития:
венозная тромбоэмболия (с лечением антикоагулянтами) или ВТЭ в анамнезе [тромбоз глубоких вен (ТГВ) или эмболия легких (ЭЛ)];
наследственная или приобретенная склонность к венозной тромбоэмболии, например резистентность к активированному протеину С (включая фактор V Ляйдена), недостаточность антитромбина III, протеина С, протеина S;
обширное оперативное вмешательство с длительной иммобилизацией (см. раздел «Особенности применения»);
повышенный риск венозной тромбоэмболии вследствие наличия множественных факторов риска (см. раздел «Особенности применения»).
Артериальная тромбоэмболия (АТЕ) или риск ее развития:
артериальная тромбоэмболия, в том числе в анамнезе (например, инфаркт миокарда), или продромальная стадия тромбоза (например, стенокардия);
цереброваскулярные заболевания: острые нарушения мозгового кровообращения, инсульт в анамнезе или продромальная стадия тромбоза (например, транзиторная ишемическая атака);
наследственная или приобретенная склонность к артериальному тромбозу, например гипергомоцистеинемия и антифосфолипидные антитела (антикардиолипин-антитела, волчаночный антикоагулянт);
мигрень с фокальными неврологическими симптомами в анамнезе;
повышенный риск артериальной тромбоэмболии вследствие наличия множественных факторов риска (см. раздел «Особенности применения») или одного из перечисленных ниже серьезных факторов риска:
сахарный диабет с сосудистыми симптомами;
тяжелая артериальная гипертензия;
тяжелая дислипопротеинемия.
Повышенная чувствительность к действующим веществам препарата или к любому из вспомогательных веществ.
Подтвержденная или подозреваемая карцинома молочных желез.
Рак эндометрия или другие подтвержденные или подозреваемые эстрогензависимые новообразования.
Нарушение функции печени вследствие острой или хронической гепатоцеллюлярной болезни.
Аденома или карцинома печени.
Недиагностированное генитальное кровотечение.
Одновременное применение с лекарственными средствами, содержащими омбітасвір/паритапревір/ритонавир и дасабувір, лекарственными средствами, содержащими глекапревір/пібрентасвір или софосбувір/велпатасвір/воксилапревір (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Особые меры безопасности
Сразу после удаления пластыря (ТТС) Эвра® из пакетика его следует плотно приклеить к коже.
Для предотвращения ухудшения адгезивных свойств пластыря (ТТС) Эвра® не следует применять кремы, лосьоны или порошки на участок кожи, где планируется применение пластыря.
После снятия пластырь еще содержит значительное количество активных веществ. Остаточные гормоны могут навредить окружающей среде в случае их попадания в воду, поэтому использованные пластыри (ТТС) Евра® следует осторожно утилизировать. Для этого отделить липкую ленту с внешней стороны пакетика. Использованный пластырь (ТТС) Евра® следует поместить в пакетик таким образом, чтобы его липкая поверхность была обращена к закрашенной зоне пакетика, и, слегка прижав, заклеить. Любой неиспользованный материал или отходы должны быть утилизированы согласно местным требованиям. Использованные пластыри (ТТС) Евра® нельзя выбрасывать в унитаз или канализацию.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействия
Следует ознакомиться с инструкцией по медицинскому применению сопутствующего лекарственного средства для определения возможных взаимодействий.
Фармакодинамические взаимодействия
Во время клинических исследований с участием пациентов, получавших лекарственные средства для лечения инфекций вирусного гепатита С (HCV), содержащие омбітасвір/паритапревір/ритонавир и дасабувір с рибавирином или без него, было выявлено повышение трансаминазы (АЛТ) более чем в 5 раз выше верхней границы нормы (ВГН). Это происходило со значительно большей частотой у женщин, которые применяли лекарственные средства, содержащие этинилэстрадиол, в том числе и комбинированные гормональные контрацептивы (КГК). Кроме того, также в случае лечения глекапревіром/пібрентасвіром или софосбувіром/велпатасвіром/воксилапревіром наблюдалось повышение АЛТ у женщин, которые принимали лекарственные средства, содержащие этинилэстрадиол, такие как КГК (см. раздел «Противопоказания»). Поэтому женщины, которые используют Евра®, должны начать применять альтернативные методы контрацепции (например, контрацептивы, содержащие только прогестагены или негормональные методы контрацепции), до того как начать лечение по этой схеме. Применение Эвра® можно начать снова через 2 недели после завершения лечения по этой комбинированной схеме.
Влияние других лекарственных средств на Эвра®
Могут наблюдаться взаимодействия с лекарственными средствами, которые усиливают действие печеночных энзимов, что приводит к увеличению клиренса половых гормонов, что, в свою очередь, может привести к прорывному кровотечению и/или потере контрацептивного эффекта. Были описаны нижеуказанные взаимодействия.
Лекарственные средства, увеличивающие клиренс КГК (сниженная эффективность КГК, вызванная индукцией ферментов): барбитураты, бозентан, карбамазепин, фенитоин, примидон, рифампицин, модафинил, ВИЧ-препараты ритонавир, невирапин, эфавиренц и, возможно, фелбамат, гризеофульвин, окскарбазепин, топирамат и продукты, содержащие экстракт зверобоя (Hypericum perforatum).
Управление рисками
Повышение уровня ферментов может наблюдаться через несколько дней после начала лечения. Максимальная активация ферментов в целом проявлялась в течение 10 дней и затем держалась в течение 4 недель после прекращения терапии.
Краткосрочное лечение краткосрочное лечение
Женщины, которые проходят краткосрочное лечение любыми из указанных классов лекарственных средств или отдельных активных веществ, индуцирующих печеночные ферменты, должны временно использовать барьерный метод защиты дополнительно к Евра® в течение одновременного применения лекарственного средства и 28 дней после его прекращения.
Если одновременный прием лекарственного препарата продолжается после окончания одной недели применения пластыря, следующий трансдермальный пластырь нужно приклеить без обычного перерыва в его применении.
Долгосрочное лечение
Женщинам, которые проходят долгосрочное лечение любыми из указанных классов лекарственных средств, рекомендуется применять другой надежный негормональный способ контрацепции.
Лекарственные средства, влияющие на клиренс КГК
При одновременном применении с КГК различные комбинации ингибиторов протеазы ВИЧ и ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ), включая комбинации препаратов для лечения инфекции вируса гепатита С (ВГС), могут повышать или снижать концентрацию эстрогена и прогестинов в плазме крови. В некоторых случаях результат таких изменений концентрации может быть клинически важным.
Поэтому перед одновременным применением следует ознакомиться с инструкциями для медицинского применения лекарственных средств для лечения ВИЧ-инфекции в части возможных взаимодействий и связанных с ними рекомендаций по применению. При возникновении сомнений женщинам, которые применяют ингибиторы протеазы или ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ), следует применять дополнительный барьерный метод контрацепции.
Угнетение метаболизма этинилэстрадиола
Еторикоксиб проявил повышение уровня ЭЭ в плазме крови (на 50-60 %) при одновременном приеме с пероральными трехфазными гормональными контрацептивами. Считается, что эторикоксиб повышает уровни ЭЭ за счет угнетения активности сульфотрансферазы, таким образом подавляя метаболизм ЭЭ.
Влияние Эвра® на другие лекарственные средства
Гормональные контрацептивы могут влиять на метаболизм некоторых других активных веществ. Соответственно, концентрации в плазме крови и тканях могут повыситься (например, циклоспорина). Может возникнуть необходимость в регулировании дозировки сопутствующего лекарственного средства.
Ламотриджин: комбинированные гормональные контрацептивы значительно снижают концентрации ламотриджина в плазме крови при одновременном применении за счет индукции глюкуронидации ламотриджина. Это может снижать терапевтический эффект; может потребоваться коррекция дозы ламотриджина.
Лабораторные показатели
Применение гормональных контрацептивов может повлиять на результаты некоторых лабораторных анализов, включая биохимические показатели печени, щитовидной железы, надпочечников и почек, уровень белков (переносчиков) в плазме крови, например, кортикостероїдзв'язуючого глобулина и фракции жиров/липопротеидов, параметры метаболизма углеводов и параметры коагуляции и фибринолиза. Изменения в целом остаются в пределах лабораторных норм.
Особенности по применению
Если присутствует любое из указанных ниже состояний/факторов риска, следует рассмотреть пользу от применения лекарственного средства Эвра® и возможные риски для каждой женщины индивидуально и обсудить с женщиной перед тем, как она решит начать применять пластырь Эвра®.
Женщине следует объяснить, что в случае ухудшения, обострения или появления одного из этих состояний или факторов риска ей необходимо обратиться к врачу, который решит, стоит ли прекращать применение препарата.
Нет клинических доказательств того, что трансдермальный пластырь в любом аспекте является безопаснее комбинированных пероральных контрацептивов.
Лекарственное средство Эвра® не показан в период беременности (см. раздел «Применение в период беременности или кормления грудью»).
Риск венозной тромбоэмболии (ВТЭ)
Применение любого комбинированного гормонального контрацептива повышает риск венозной тромбоэмболии по сравнению с тем, когда такие препараты не применяют. Средства, содержащие левоноргестрел, норгестимат или норэтистерон ассоциируются с наименьшим риском ВТЭ. Другие средства, такие как Эвра®, могут иметь вдвое более высокий уровень риска развития ВТЭ. Решение о применении лекарственного средства следует принимать только после обсуждения с женщиной, убедившись в том, что она осознает риск развития ВТЭ при применении пластыря Эвра® и понимает, как имеющиеся у нее факторы риска влияют на этот риск и что риск ВТЭ является самым высоким в течение первого года использования пластыря. Существуют также некоторые свидетельства того, что риск возрастает, когда комбинированные пероральные контрацептивы (КПК) назначают повторно после перерыва в использовании 4 недели и более.
Примерно у 2 из 10 000 женщин, которые не применяют КГК и не беременны, развивается ВТЭ в течение 1 года. Однако у каждой женщины этот риск может быть намного выше в зависимости от имеющихся у нее факторов риска (см. ниже).
Установлено, что из 10 000 женщин, применяющих низкие дозы КГК, содержащих левоногестрел, примерно у 61 развивается ВТЭ в течение 1 года. Согласно исследованиям частота развития ВТЭ у женщин, применяющих пластырь Эвра® составляет примерно 6-12 случаев на 10000 женщин в год, что вдвое выше, чем у женщин, которые применяю КГК, содержащие левоноргестрел.
Количество случаев ВТЭ в год при применении КГК ниже, чем количество случаев ВТЭ, что развивается у женщин во время беременности или в послеродовой период.
ВТЭ может иметь летальный исход в 1-2% случаев.
1 Медиана диапазона от 5 до 7 на 10 000 женщин-лет установлена по относительному риску при применении КГК, содержащих левоногестрел, по сравнению с неприменением средства - от 2,3 до 3,6.
Очень редко сообщалось о случаях тромбоза других кровеносных сосудов, например печеночной, брыжеечной, почечной вен или вен/артерий сетчатки, среди женщин, которые применяли КГК.
Факторы риска ВТЭ
Риск развития венозных тромбоэмболических осложнений у женщин, применяющих КГК, значительно повышается при наличии дополнительных факторов риска, особенно множественных (см. таблицу 2).
Применение пластыря Эвра® противопоказано женщинам, которые имеют множественные факторы риска развития венозного тромбоза (см. раздел «Противопоказания»). Если женщина имеет более одного фактора риска, не исключено, что общий риск больше, чем сумма отдельных факторов - в этом случае следует взвесить общий риск ВТЭ у женщины. Если соотношение риска и пользы считается отрицательным, КГК не следует назначать (см. раздел «Противопоказания»).
Таблица 2
Факторы риска ВТЭ
| Фактор риска | Комментарий |
| Избыточная масса тела (индекс массы тела более 30 кг/м2) | Риск значительно повышается при увеличении индекса массы тела. Особенно важно учитывать наличие других факторов риска. |
|
Длительная иммобилизация, обширные оперативные вмешательства, операции на нижних конечностях или тазу, нейрохирургия, серьезные травмы. Примечание: временная иммобилизация, включая авиа перелеты продолжительностью > 4 часов, также может быть фактором риска ВТЭ, особенно у женщин с другими факторами риска. |
В таких случаях рекомендуется прекратить применение пластыря (в случае плановой операции - минимум за 4 недели до вмешательства) и не продолжать пока не пройдет 2 недели с момента полного восстановления движений. Следует использовать другой метод контрацепции для предупреждения нежелательной беременности. Следует рассмотреть необходимость применения антикоагулянтов если применение пластыря Эвра® не было прекращено заблаговременно. |
|
Отягощенный семейный анамнез (например, венозная тромбоэмболия у брата/сестры или родителей в относительно молодом возрасте). |
При подозрении на наследственную предрасположенность женщина должна обратиться за советом к специалисту перед принятием решения о применении комбинированных гормональных контрацептивов. |
| Другие медицинские состояния, ассоциированные с ВТЭ | Злокачественная опухоль, системная красная волчанка, гемолитический уремический уремический синдром, хронические воспалительные заболевания кишечника (например, болезнь Крона или язвенный колит), серповидноклеточная анемия. |
| Увеличение возраста | Особенно свыше 35 лет. |
Не существует общепринятого мнения относительно возможной роли варикоза вен и распространенного тромбофлебита в этиологии венозной тромбоэмболии.
Следует принимать во внимание повышенный риск тромбоэмболии во время беременности, и особенно в течение 6-недельного периода после родов (для дополнительной информации см. раздел «Применение в период беременности или кормления грудью»).
Симптомы ВТЭ (тромбоз глубоких вен и эмболия легких)
Женщины, которые применяют комбинированные контрацептивы, должны немедленно сообщить врачу о появлении симптомов тромбоза.
Симптомы тромбоза глубоких вен (ТГВ) включают:
односторонний отек ноги и/или стопы или отек вдоль вены на ноге;
боль или болезненные ощущения в ноге, которые ощущаются только при стоянии и ходьбе;
повышенную температуру пораженной ноги, покраснение или бледность кожи ноги.
Симптомы эмболии легких (ЭЛ) включают:
внезапное нарушение дыхания или учащенное дыхание;
внезапный кашель, который может сопровождаться кровохарканьем;
резкая боль в груди;
предобморочное состояние или головокружение;
быстрое или нерегулярное сердцебиение.
Некоторые из этих симптомов являются неспецифическими (например, нарушение дыхания, кашель) и могут быть приняты за признаки другого более распространенного и менее тяжелого состояния (например, инфекции дыхательных путей).
Другие признаки окклюзии сосудов включают: внезапную боль, отек и незначительное посинение конечности.
Если окклюзия происходит в сосудах глаза, симптомы могут варьировать от безболезненного ухудшения зрения до его потери. Иногда потеря зрения происходит почти моментально.
Риск артериальной тромбоэмболии (АТЕ)
Эпидемиологические исследования связывают использование КГК с повышенным риском артериальной тромбоэмболии (инфаркт миокарда) или нарушением мозгового кровообращения (например, транзиторная ишемическая атака, инсульт). Артериальная тромбоэмболия может иметь летальный исход.
Факторы риска АТЕ
Риск артериальных тромбоэмболических осложнений или нарушения мозгового кровообращения у пациентов, применяющих КГК, увеличивается у женщин с факторами риска (см. таблицу 3). Применение пластыря Эвра® противопоказано женщинам, которые имеют серьезные или множественные факторы риска развития ATE (см. раздел «Противопоказания»). Если женщина имеет более одного фактора риска, не исключено, что общий риск больше, чем сумма отдельных факторов - в этом случае следует взвесить общий риск АТЕ у женщины. Если соотношение риска и пользы считается отрицательным, КГК не следует назначать (см. раздел «Противопоказания»).
Таблица 3
Факторы риска АТЕ
| Фактор риска | Комментарий |
| Увеличение возраста | Особенно свыше 35 лет. |
| Курение | Женщинам настоятельно рекомендуется не курить, если они хотят применять КГК. Женщинам в возрасте от 35 лет, которые продолжают курить, рекомендовано применять другие методы контрацепции. |
| Гипертензия | |
| Избыточная масса тела (индекс массы тела более 30 кг/м2) | Риск значительно повышается при увеличении индекса массы тела. Особенно важно учитывать наличие других факторов риска. |
| Отягощенный семейный анамнез (например, артериальная тромбоэмболия у брата или у родителей в относительно молодом возрасте, то есть менее 50 лет). | При подозрении на наследственную предрасположенность женщина должна обратиться за советом к специалисту перед принятием решения о применении гормональных контрацептивов. |
| Мигрень | Увеличение частоты или тяжести случаев мигрени во время применения КГК (что может быть продромальным состоянием нарушения мозгового кровообращения) может быть причиной немедленного прекращения применения пластыря. |
| Другие медицинские состояния, ассоциированные с нежелательными сосудистыми нарушениями | Сахарный диабет, гипергомоцистеинемия, заболевания клапанов сердца и мерцательная аритмия, дислипопротеинемия, системная красная волчанка. |
Симптомы АТЕ
Женщины, которые применяют комбинированные контрацептивы, должны немедленно сообщить врачу при появлении симптомов АТЕ.
Симптомы нарушения мозгового кровообращения включают:
внезапная слабость или онемение лица, руки или ноги, особенно на одной стороне тела;
внезапное затруднение ходьбы, головокружение, потеря равновесия или координации;
внезапная спутанность сознания, проблемы с речью или пониманием;
внезапные проблемы со зрением одного или обоих глаз;
внезапная, сильная или длительная головная боль без определенной причины;
потеря сознания или обморок с конвульсиями или без.
Временные симптомы позволяют подозревать транзиторную ишемическую атаку.
Симптомы инфаркта миокарда включают:
боль, дискомфорт, давление, тяжесть, ощущение сдавливания или распирания в груди, руке, или ниже грудины;
дискомфорт с иррадиацией в спину, челюсть, горло, руки, живот;
ощущение переполнения желудка, расстройства желудка или удушье;
потливость, тошнота, рвота и головокружение;
сильная слабость, беспокойство или одышка;
быстрое или нерегулярное сердцебиение.
Женщины, которые применяют комбинированные контрацептивы, должны немедленно сообщить врачу о возможных симптомах тромбоза. В случае подозреваемого или подтвержденного тромбоза прием гормональных контрацептивов необходимо прекратить. Адекватную контрацепцию нужно начать из-за тератогенности антикоагулянтной терапии (кумарины).
Опухоли
В ходе некоторых эпидемиологических исследований сообщалось о повышенном риске развития рака шейки матки при длительном применении КПК, но до сих пор не установлено, насколько это открытие зависит от сочетания влияния полового поведения и других факторов, таких как вирус папилломы человека (ВПЧ).
Метаанализ 54 эпидемиологических исследований показал, что существует несколько повышенный риск (относительный риск = 1,24) возникновения рака груди у женщин, принимающих КПК. Риск постепенно уменьшается в течение 10 лет после прекращения применения КПК. Поскольку рак груди является редким среди женщин в возрасте до 40 лет, количество диагнозов рака груди у лиц, которые применяли или применяют КПК, является малой по сравнению с общим риском рака груди. Рак молочной железы, диагностированный у постоянных пользователей КПК, как правило, менее клинически распространен, чем у женщин, которые никогда не принимали контрацептивы.
Повышенный риск может быть связан с ранней диагностикой рака груди среди пациентов, применяющих КПК, биологическими эффектами КПК или с комбинацией обеих причин.
Редко сообщалось о доброкачественных опухолях печени и еще реже о злокачественных опухолях печени среди пациентов, которые применяли КПК. В отдельных случаях эти опухоли привели к внутрибрюшным кровотечениям, угрожавшим жизни. Таким образом, следует проводить дифференциальную диагностику с печеночной опухолью при жалобах на острую боль в животе, увеличении печени и признаках внутрибрюшного кровотечения у женщин, которые применяли лекарственное средство Эвра®.
Расстройства со стороны психики
Известными побочными эффектами применения гормональных контрацептивов являются угнетение настроения и депрессия (см. раздел «Побочные реакции»). Депрессия может быть тяжелой и является хорошо известным фактором риска суицидального поведения и суицида. Женщин следует проинструктировать о необходимости обратиться к врачу в случае возникновения изменений настроения и симптомов депрессии, включая такие, которые возникли вскоре после начала применения КПК.
Другие состояния
Контрацептивная эффективность может быть снижена у женщин, масса тела которых составляет или превышает 90 кг (см. разделы «Способ применения и дозы» и «Фармакодинамика»).
Женщины с гипертриглицеридемией или с такими случаями в семейном анамнезе имеют повышенный риск развития панкреатита при применении комбинированных гормональных контрацептивов.
Хотя незначительное повышение артериального давления наблюдалось у многих женщин, принимавших гормональные контрацептивы, клинически существенное повышение наблюдалось редко. Связь между применением гормональных контрацептивов и клинической артериальной гипертензией не была установлена. Если во время применения комбинированных гормональных контрацептивов на фоне существующей артериальной гипертензии наблюдается постоянное или значительное повышение артериального давления, которое не отвечает на антигипертензивное лечение, применение комбинированных гормональных контрацептивов нужно прекратить. Комбинированные гормональные контрацептивы можно снова применять, если антигипертензивная терапия обеспечивает контроль нормального уровня артериального давления.
Такие состояния появлялись или ухудшались или в период беременности, или при применении КПК, но доказательства связи с применением КПК неубедительны: желтуха и/или зуд, связанный с холестазом; заболевания желчного пузыря, включая холецистит и желчнокаменную болезнь; порфирия; системная красная волчанка; гемолитический уремический синдром; хорея Сиденхама; герпес беременных; потеря слуха, связанная с отосклерозом.
Острые и хронические нарушения печеночной функции могут потребовать прекращения комбинированной гормональной контрацепции до момента, когда печеночные маркеры вернутся к норме. Рецидив зуда, связанного с холестазом, возникшего в период предыдущей беременности или предыдущего применения половых стероидов, требует прекращения приема комбинированных гормональных контрацептивов.
Несмотря на то, что комбинированные гормональные контрацептивы могут повлиять на периферическую инсулинорезистентность и переносимость глюкозы, нет доказательств необходимости изменения терапевтического режима при сахарном диабете в период применения гормональных контрацептивов. Однако женщины, больные сахарным диабетом, должны постоянно находиться под контролем врачей, особенно на ранних стадиях применения лекарственного средства Эвра®.
Во время применения КПК сообщалось об осложнениях эндогенной депрессии, эпилепсии, болезни Крона или язвенного колита.
Экзогенные эстрогены могут индуцировать или усиливать симптомы наследственного и приобретенного ангионевротического отека.
Хлоазма может возникнуть при применении гормональных контрацептивов, особенно у женщин с хлоазмой беременных в анамнезе. Пациенты со склонностью к хлоазмы должны избегать солнца или УФ облучения при применении Эвра®. Хлоазма часто является необратимой.
Медицинский осмотр/консультация
Перед началом или возобновлением приема Эвра® необходимо рассмотреть полную историю болезни (включая семейный анамнез) и исключить беременность. Нужно измерить артериальное давление и провести физический осмотр для установления наличия противопоказаний (см. раздел «Противопоказания») и предупреждений (см. раздел «Особенности применения»). Важно обратить внимание женщины на информацию о венозного и артериального тромбоза, в том числе относительно риска применения пластыря Эвра® по сравнению с другими КГК, симптомы ВТЭ и ATE, известные факторы риска и поведения в случае подозрения на тромбоз.
Женщина должна быть проинструктирована внимательно ознакомиться с инструкцией к медицинскому применению лекарственного средства и придерживаться предоставленных рекомендаций. Частота и объем последующих медицинских осмотров должны быть установлены в соответствии с существующей клинической практикой и клинического состояния женщины.
Женщине нужно сообщить о том, что гормональные контрацептивы не защищают от ВИЧ-инфекции (СПИД) и других болезней, передающихся половым путем.
Нарушение режима кровотечений
Как и при применении других комбинированных гормональных контрацептивов, в течение первых месяцев применения могут наблюдаться нерегулярные кровотечения (мажущие выделения или прорывные кровотечения). Поэтому консультация специалиста может быть полезной только после периода привыкания продолжительностью примерно 3 цикла. Если прорывные кровотечения сохраняются постоянно или возникают после регулярного кровотечения в предыдущих циклах при применении лекарственного средства Эвра® в соответствии с рекомендациями, нужно рассмотреть существование другой причины. Следует обратить внимание на негормональные причины, и, при необходимости, принять диагностические меры для исключения органического заболевания или беременности. Эти меры могут включать выскабливание. У некоторых женщин менструация может не возникнуть в период, свободный от применения пластыря. Если лекарственное средство Эвра® применяли в соответствии с рекомендациями раздела «Способ применения и дозы», маловероятно, что женщина беременна. Беременность нельзя исключить, если пластырь Эвра® применяли не в соответствии с инструкцией перед первой или второй пропущенными менструациями.
У некоторых женщин может быть аменорея или олигоменорея после прерывания гормональной контрацепции, особенно при наличии этих состояний в анамнезе.
Применение в период беременности или кормления грудью
Беременность
Пластырь Эвра® не показан для применения в период беременности.
Эпидемиологические исследования продемонстрировали отсутствие увеличенного риска врожденных дефектов у детей, рожденных женщинами, которые применяли гормональные контрацептивы перед беременностью. Большинство недавних исследований также не показали тератогенных эффектов при непреднамеренном применении пероральных гормональных контрацептивов в начале беременности.
Ограниченные данные по применению препарата Эвра® беременным женщинам не дают возможности сделать вывод о безопасности этого средства в течение беременности.
В ходе исследований на животных были случаи побочных реакций в период беременности или кормления грудью. Поэтому не следует исключать риск возникновения побочных реакций вследствие гормонального нарушения при применении лекарственного средства Эвра®, хотя общий опыт применения комбинированных пероральных контрацептивов в период беременности не показал никаких признаков нежелательных эффектов у человека.
Если беременность возникла в течение применения пластыря Эвра®, его применение следует немедленно прекратить.
Следует учитывать повышенный риск развития ВТЭ в послеродовом периоде при принятии решения о возобновлении применения пластыря Эвра® (см. раздел «Способ применения и дозы», «Особенности применения»).
Кормление грудью
Также применение комбинированных гормональных контрацептивов в послеродовом периоде может негативно повлиять на количество и качество грудного молока. Матерям, которые кормят грудью, не следует применять пластырь (ТТС) Эвра® до завершения периода кормления грудью.
Фертильность
После прекращения применения препарата Эвра® может наблюдаться задержка оплодотворения.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Пластырь (ТТС) Эвра® не влияет или незначительно влияет на скорость реакции при управлении автотранспортом или работе с другими механизмами.
Способ применения и дозы
Дозы.
Для достижения максимального контрацептивного эффекта женщина должна применять пластырь (ТТС) Эвра®, строго следуя инструкциям, приведенным ниже в разделе «Как начать применение пластыря (ТТС) Эвра®».
Одновременно можно использовать только 1 пластырь (ТТС) Эвра®.
Каждый использованный пластырь (ТТС) Эвра® снимать и сразу заменять новым в один и тот же день недели - «день замены» - на 8-й и 15-й дни менструального цикла. Замену использованного пластыря можно проводить в любое время «дня замены». В течение 4-й недели, с 22-го дня цикла, пластырь (ТТС) Эвра® не применять.
Новый контрацептивный цикл начинается со следующего дня после окончания 4-й недели; следующий пластырь (ТТС) Эвра® следует наклеивать, даже если кровотечения отмены не было или оно не закончилось.
Hi при каких обстоятельствах перерыв в использовании пластыря (ТТС) Эвра® не должен превышать 7 дней. Если произошел перерыв дольше 7 дней, женщина может быть не защищена от наступления беременности. В таких случаях в течение 7 дней необходимо дополнительно использовать барьерный метод контрацепции, поскольку риск овуляции возрастает с каждым днем увеличения рекомендуемой продолжительности периода, свободного от применения пластыря (ТТС) Эвра®. В случае полового сношения во время такого периода следует учитывать вероятность зачатия.
Особые категории пациентов
Масса тела 90 кг или более: у женщин с массой тела 90 кг и более эффективность контрацепции может быть снижена.
Почечная недостаточность: применение лекарственного средства Эвра® женщинам с почечной недостаточностью не изучалось. Потребности снижать дозу нет, однако данные свидетельствуют о более высоком уровне несвязанной фракции этинилэстрадиола, поэтому препарат Эвра® этой категории пациентов следует применять под контролем.
Печеночная недостаточность: применение препарата Эвра® женщинам с печеночной недостаточностью не изучалось. Эвра® противопоказана женщинам с печеночной недостаточностью (см. раздел «Противопоказания»).
Пациенты пожилого возраста: Эвра® не предназначена для применения в качестве гормональной заместительной терапии женщинам в период постменопаузы.
Дети: безопасность и эффективность пластыря (ТТС) Эвра® установлена для женщин в возрасте от 18 лет. Не рекомендуется применять Эвра® до наступления первой менструации.
Способ применения.
Пластырь (ТТС) Эвра® следует наклеивать на чистую, сухую, интактную и здоровую кожу ягодиц, живота, внешнюю поверхность верхней части плеча или верхней части туловища без оволосения, на участках, где она не будет контактировать с одеждой, которая плотно прилегает к телу. Пластырь (ТТС) Эвра® нельзя приклеивать на грудь или участки кожи с покраснением, раздражением или порезами. Чтобы избежать возможного раздражения, каждый следующий пластырь (ТТС) Эвра® необходимо наклеивать на другой участок кожи, это можно делать в пределах одной и той же анатомической области.
Пластырь (ТТС) Эвра® необходимо плотно прижать, чтобы его края хорошо прилегали к коже.
Для предотвращения снижения адгезивных свойств пластыря (ТТС) Евра® нельзя наносить макияж, кремы, лосьоны, пудры и другие локальные средства на те участки кожи, где он приклеен или будет приклеен.
Женщина должна ежедневно осматривать трансдермальный пластырь для того, чтобы быть уверенной в его плотном приклеивании.
Пластырь (ТТС) Эвра® нельзя разрезать, повреждать или изменять каким-либо образом, поскольку это может поставить под угрозу эффективность контрацепции.
Использованный трансдермальный пластырь необходимо утилизировать в соответствии с инструкциями, приведенными в разделе «Особые меры безопасности».
Как начать применение пластыря (ТТС) Эвра®?
Если во время предыдущего менструального цикла женщина не применяла гормональный контрацептив
Контрацепцию с помощью пластыря (ТТС) Эвра® начинать в 1-й день менструации. Приклеивать к коже 1 пластырь (ТТС) Эвра® и носить его всю неделю (7 дней). День приклеивания первого пластыря (ТТС) Эвра® (l-й день/день начала) определяет последующие дни замены. День замены будет приходиться на этот же день каждой недели (8-й, 15-й, 22-й дни цикла и 1-й день следующего цикла). На 22-й день цикла пластырь Евра® снимать, и в течение четвертой недели цикла женщина не применяет пластырь (ТТС) Евра®.
Если женщина начинает применение трансдермального пластыря (ТТС) Эвра® не с первого дня цикла, то следует одновременно использовать барьерные методы контрацепции в течение 7 первых дней первого контрацептивного цикла.
Если женщина переходит с применения комбинированного перорального контрацептива на использование пластыря (ТТС) Эвра®
Пластырь (ТТС) Эвра® следует наклеивать на кожу в 1-й день менструации, которая начинается после прекращения приема комбинированного перорального контрацептива. Если в течение 5 дней после приема контрацептивной таблетки менструация не начинается, перед началом применения пластыря (ТТС) Эвра® необходимо исключить беременность. Если применение Эвра® начать позже первого дня менструации, то в течение 7 дней необходимо одновременно использовать барьерные методы контрацепции.
Если после приема последней контрацептивной таблетки прошло более 7 дней, то у женщины может возникнуть овуляция, и поэтому она должна проконсультироваться с врачом перед тем, как начать применение пластыря (ТТС) Евра®. Половые сношения во время этого увеличенного периода, свободного от приема контрацептивных таблеток, могут привести к наступлению беременности.
Если женщина переходит с применения препаратов, содержащих только прогестаген, на применение пластыря (ТТС) Эвра®
Женщина может в любой день перейти с применения препарата, содержащего только прогестаген (в день удаления имплантата, в день, когда нужно сделать очередную инъекцию), на применение пластыря (ТТС) Евра®, но в течение первых 7 дней применения пластыря (ТТС) Евра® следует использовать барьерный метод для усиления контрацептивного эффекта.
После аборта или выкидыша
После аборта или выкидыша до 20-й недели беременности можно сразу начинать применение пластыря (ТТС) Эвра®. Если женщина начинает использовать пластырь (ТТС) Эвра® сразу после аборта или выкидыша, применять дополнительный метод контрацепции не обязательно. Женщина должна знать, что овуляция может произойти в течение 10 дней после аборта или выкидыша.
После аборта или выкидыша на 20-й неделе беременности и позже применение пластыря (ТТС) Эвра® можно начинать на 21-й день после аборта или выкидыша или в первый день первой менструации. Частота возникновения овуляции на 21-й день после аборта (на 20-й неделе беременности) неизвестна.
После родов
Женщины, которые не кормят ребенка грудью, могут начинать применение пластыря (ТТС) Эвра® не ранее чем через 4 недели после родов. Если женщина начинает применять пластырь (ТТС) Эвра® позже, то в течение первых 7 дней следует дополнительно использовать барьерный метод контрацепции. Если были половые сношения, то необходимо исключить вероятность беременности перед тем, как начинать применение пластыря (ТТС) Эвра®, или женщина должна дождаться первой менструации.
Относительно применения пластыря женщинам, кормящим грудью, см. раздел «Применение в период беременности или кормления грудью».
При полном или частичном отклеивании пластыря (ТТС) Эвра®
Если пластырь (ТТС) Эвра® полностью или частично отклеился, то в кровь поступает недостаточное количество его активных компонентов.
Даже при частичном отклеивании пластыря (ТТС) Эвра®:
менее чем в течение суток (24 часа) следует снова приклеить пластырь (ТТС) Эвра® на тот же участок тела или сразу же заменить его новым трансдермальным пластырем (ТТС) Эвра®. Дополнительные контрацептивы не нужны. Следующий пластырь Эвра® необходимо приклеить в обычный «день замены»;
более чем в течение суток (24 часа), а также если женщина не знает точно, когда пластырь (ТТС) Эвра® частично или полностью отклеился: возможно наступление беременности. Женщина должна сразу же начать новый цикл, наклеив новый пластырь (ТТС) Эвра®, и считать этот день первым днем контрацептивного цикла. Барьерные методы контрацепции следует одновременно применять только в первые 7 дней нового цикла.
Не следует пытаться приклеить пластырь (ТТС) Эвра®, если он потерял свои адгезивные свойства; вместо этого необходимо сразу приклеить новый пластырь (ТТС) Эвра®. Нельзя применять дополнительные липкие ленты или повязки для удержания на месте пластыря (ТТС) Эвра®.
Если пропущены очередные дни замены пластыря (ТТС) Эвра®
В начале любого контрацептивного цикла (l-я неделя/l-й день): женщина может быть не защищена от беременности: она должна приклеить первый пластырь (ТТС) Евра® нового цикла сразу же, как только вспомнит об этом. Этот день считается новым «l-м днем» и от него отсчитывается новый «день замены». В течение первых 7 дней нового цикла следует одновременно применять негормональную контрацепцию. В случае полового сношения во время такого удлиненного периода без применения пластыря (ТТС) Эвра® может произойти оплодотворение.
В середине цикла (2-я неделя/8-й день или 3-я неделя/15-й день):
если со дня замены пластыря прошла 1 или 2 суток (до 48 часов), женщина должна сразу наклеить новый пластырь (ТТС) Эвра®. Следующий пластырь (ТТС) Эвра® необходимо приклеить в обычный «день замены». Если в течение 7 дней, предшествующих первому пропущенному дню наклеивания пластыря (ТТС) Эвра®, женщина правильно использовала пластырь, то дополнительная контрацепция не нужна;
если со дня замены пластыря прошло более 2 суток (48 часов и более), женщина может быть не защищена от наступления беременности. Она должна прекратить текущий контрацептивный цикл и сразу же начать новый 4-недельный цикл, наклеив новый пластырь (ТТС) Эвра®. Этот день считается новым «l-м днем» и отсчитывается от него «день замены». Барьерную контрацепцию следует одновременно применять в течение 7 первых дней нового цикла.
В конце цикла (4-я неделя/22-й день): если трансдермальный пластырь (ТТС) Эвра® не снят в конце 4-й недели (22-й день), его необходимо снять как можно быстрее. Очередной цикл контрацепции нужно начинать в обычный «день замены», который является следующим днем после 28-го дня. Дополнительная контрацепция не нужна.
Изменение «дня замены»
Чтобы отложить менструацию на один цикл, женщина должна приклеить новый пластырь Эвра® в начале 4-й недели (22-й день), пропустив тем самым период, свободный от применения пластыря Эвра®. Могут возникнуть межменструальные кровотечения или мажущие выделения. После 6 недель подряд применения пластыря (ТТС) Эвра® необходимо сделать 7-дневный интервал, свободный от применения пластыря (ТТС) Эвра®. После окончания этого интервала возобновить регулярное применение препарата.
Если женщина хочет изменить день замены пластыря, она должна закончить текущий цикл, снять третий пластырь (ТТС) Эвра® в назначенный для этого день. В течение недели, свободной от применения пластыря (ТТС) Эвра®, женщина может выбрать новый день замены, наклеив первый пластырь (ТТС) Эвра® следующего цикла в выбранный день. Период, свободный от применения пластыря (ТТС) Эвра®, ни в коем случае не должен превышать 7 дней. Чем короче этот период, тем выше вероятность того, что у женщины не будет следующей менструации, а во время следующего контрацептивного цикла могут возникать межменструальные кровотечения или мажущие выделения.
При незначительном раздражении кожи
Если применение пластыря (ТТС) Эвра® вызывает раздражение кожи, можно приклеить новый пластырь Эвра® на другой участок кожи и носить его до следующего «дня замены». Одновременно можно применять только 1 пластырь Эвра®.
Дети.
Пластырь (ТТС) Эвра® не рекомендуется применять детям (до 18 лет) из-за недостаточности данных по безопасности и эффективности применения. Не рекомендуется применять лекарственное средство Эвра® до наступления первой менструации.
Передозировка
При случайном применении больших доз пероральных контрацептивов не сообщалось о серьезных побочных реакциях. Передозировка может вызывать тошноту или рвоту. У некоторых женщин могут возникать влагалищные кровотечения. При подозрении на передозировку необходимо снять пластырь (ТТС) Эвра® и провести симптоматическую терапию.
Побочные эффекты
Наиболее частыми побочными реакциями, которые наблюдались во время клинических исследований, были головная боль, тошнота и чувствительность молочных желез, которые развивались примерно в 21%, 16,6% и 15,9% случаев соответственно. Побочные реакции, которые могут появляться в начале лечения, но обычно исчезают после первых трех циклов, включают мажущие выделения, нагрубание молочных желез и тошноту.
У женщин, применяющих КГК, наблюдается повышенный риск артериальных и венозных тромботических и тромбоэмболических нарушений, включая инфаркт миокарда, инсульт, транзиторные ишемические атаки, тромбоз вен и эмболию легких (см. раздел «Особенности применения»).
Безопасность пластыря (ТТС) Эвра® оценивалась с участием 3322 женщин, которые вели активную половую жизнь и участвовали в клинических исследованиях III фазы, проводившихся с целью оценки контрацептивной эффективности. Эти женщины применяли контрацепцию в течение 6 или 13 циклов (пластырь (ТТС) Эвра® или пероральный контрацептив для сравнения), приняли хотя бы одну дозу исследуемого препарата и предоставили информацию о побочных реакций. В нижеследующей таблице 3 указаны побочные реакции, наблюдавшиеся во время клинических исследований и в постмаркетинговом периоде. Частота побочных реакций оценена как: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥ 1/1000 до <1/100); редко (≥ 1/10000 до <1/1000); очень редко (<1/10000), неизвестно (частота не может быть установлена из доступных данных).
Таблица 4
Частота побочных реакций
| Системы органов/частота | ||||
| Очень часто | Часто | Нечасто | Редко | Неизвестно |
| Инфекции и инвазии | ||||
| (Вульво)вагинальные грибковые инфекции, вагинальный кандидоз | Пустулезные сыпи*, пустулы в месте применения | |||
| Доброкачественные новообразования, злокачественные и неустановленные (включая кисты и полипы) | ||||
| Печеночные новообразования*†, рак молочной железы*†, рак шейки матки*†, печеночная аденома*†, маточная лейомиома, фиброаденома молочной железы | ||||
| Со стороны иммунной системы | ||||
| Реакции гиперчувствительности | Анафилактические реакции* | Обострение симптомов наследственного и приобретенного ангионевротического отека* | ||
| Метаболические нарушения | ||||
| Гиперхолестеринемия, задержка жидкости, повышение аппетита | Гипергликемия*, резистентность к инсулину* | |||
| Психические расстройства | ||||
| Изменения настроения, лабильность эмоциональных реакций, беспокойство | Бессонница, снижение либидо | Агрессия*, расстроенность*, повышение либидо | ||
| Со стороны центральной и периферической нервной системы | ||||
| Головная боль | Мигрень, головокружение | Острые нарушения мозгового кровообращения**†, мозговое кровотечение*†, искажение вкуса* | ||
| Со стороны органов зрения | ||||
| Непереносимость контактных линз* | ||||
| Со стороны сердца | ||||
| Артериальная тромбоэмболия, (острый) инфаркт миокарда*† | ||||
| Со стороны сосудистой системы | ||||
| Артериальная гипертензия | Гипертензивный криз*, артериальный тромбоз**†, венозный тромбоз**†, тромбоз*†, венозная тромбоэмболия | |||
| Со стороны дыхательной системы | ||||
| Легочный (артериальный) тромбоз*†, легочная эмболия† | ||||
| Со стороны пищеварительной системы | ||||
| Тошнота | Боль в животе, рвота, диарея, вздутие живота | Колит* | ||
| Со стороны гепатобилиарной системы | ||||
| Холецистит, холелитиаз†, поражение печени*, холестатическая желтуха*†, холестаз*† | ||||
| Со стороны кожи и подкожной ткани | ||||
| Акне, высыпания, зуд, кожные реакции, раздражение кожи | Алопеция, аллергический дерматит, экзема, реакции фоточувствительности, контактный дерматит, крапивница, эритема | Ангионевротический отек*, эритема (мультиформная, узелковая)*, хлоазма†, эксфолиативные высыпания*, генерализованный зуд, высыпания (эритематозные, зудящие), себорейный дерматит* | ||
| Со стороны костно-мышечной системы | ||||
| Спазмы мышц | ||||
| Со стороны репродуктивной системы | ||||
| Нагрубание молочных желез | Дисменорея, маточные кровотечения и менструальные расстройства**†, спазм матки, дискомфорт в груди, вагинальные расстройства | Галакторея, предменструальный синдром, вульвовагинальная сухость | Дисплазия шейки матки*, ухудшение лактации, генитальные выделения | |
| Общие расстройства и реакции в месте введения | ||||
| Недомогание, повышенная утомляемость, реакции в месте применения (эритема, раздражение, зуд, сыпь) | Генерализованный отек, периферический отек, реакции в месте применения** | Отек лица*, точечный отек*, отеки, реакции в месте применения* (абсцесс, эрозия), локализованный отек* | ||
| Результаты лабораторных исследований | ||||
| Увеличение массы тела | Повышение артериального давления, нарушение уровня триглицеридов крови** | Снижение уровня глюкозы крови*†, нарушение уровня глюкозы крови*† |
*Побичные реакции, выявленные в послерегистрационный период.
**Включая побочные реакции, выявленные в ходе клинических исследований и послерегистрационного периода.
См. раздел «Особенности применения».
Сообщение о подозреваемых побочных реакциях
Сообщение о побочных реакциях после регистрации лекарственного средства имеет важное значение. Это позволяет проводить мониторинг соотношения польза/риск при применении этого лекарственного средства. Медицинским и фармацевтическим работникам, а также пациентам или их законным представителям следует сообщать обо всех случаях подозреваемых побочных реакций и отсутствия эффективности лекарственного средства через Автоматизированную информационную систему по фармаконадзору по ссылке: https://aisf.dec.gov.ua.
Срок годности
2 года.
Условия хранения
Хранить в оригинальной упаковке при температуре не выше 30 °С в недоступном для детей месте. Не хранить в холодильнике или морозильной камере.
Упаковка
По 1 пластырю в пакете из ламинированной бумаги и алюминиевой фольги; по 3 пакета в прозрачном пакетике из полимерной пленки; по 1 или 3 прозрачные пакетики (3 или 9 пластырей) вместе со специальными наклейками на календарь для отметок об использовании пластыря (ТТС) в картонной упаковке.
Категория отпуска
По рецепту.
Производитель
Производство нерасфасованного продукта и первичная упаковка:
ЛТС Ломанн Терапевтические Системы АГ/ LTS Lohmann Therapie - Systeme AG.
Вторичная упаковка и выпуск серии:
Янссен Фармацевтика НВ/Janssen Pharmaceutica NV
ОАО «Гедеон Рихтер»/Gedeon Richter Plc.
Местонахождение производителя и его адрес места осуществления деятельности.
Ломаннштрассе, 2, Д-56626, Андернах, Германия/ Lohmannstrasse 2, D-56626 Andernach, Germany.
Турнхоутсевег 30, Беерсе, 2340, Бельгия/Turnhoutseweg 30, Beerse, 2340, Belgium.
Н-1103, Будапешт, ул. Демреи, 19-21, Венгрия/ Н-1103, Budapest, Gyomroi ut., 19-21, Hungary.
Часто задаваемые вопросы
Какая цена на Евра пластырь ТТС №3?
В чем особенности товара Евра пластырь ТТС №3?
Какие действующие вещества у Евра пластырь ТТС №3?
Какие отзывы у товара Евра пластырь ТТС №3?
Пластир дуже зручний у використанні. Наклеїла один раз, і можна забути про щоденне приймання таблеток. Він тримається добре, навіть під час душу, і жодного дискомфорту не відчуваю. Для мене це ідеальний варіант контрацепції, бо більше не потрібно постійно пам'ятати про таблетки.
Евра - Фармакологические свойства
Фармакодинамика препарата евра основана на его способности предотвращать оплодотворение путем угнетения гонадотропинов через эстрогенное и прогестагенное действие этинилэстрадиола и норэльгестромина.
Главный механизм действия заключается в ингибировании овуляции, а также изменениях цервикальной слизи и эндометрия, что способствует увеличению эффективности препарата.
Фармакокинетика пластыря евра показывает, что равновесная концентрация норэльгестромина и этинилэстрадиола в плазме крови достигается через 48 часов после нанесения.
При длительном применении концентрации этих веществ незначительно увеличиваются по сравнению с первой неделей цикла.
Физическая активность и ванны с холодной водой оказывают ограниченное влияние на фармакокинетические параметры норэльгестромина и этинилэстрадиола, хотя для последнего наблюдается некоторое увеличение при физической нагрузке.
Метаболизм норэльгестромина и этинилэстрадиола происходит в печени, с последующим выведением метаболитов через мочу и кал.
Пластырь Евра и пероральные комбинированные контрацептивы имеют разные фармакокинетические профили, что требует особой осторожности при их сравнении.
Исследования также показали, что фармакокинетика норэльгестромина и этинилэстрадиола может варьироваться в зависимости от возраста, массы тела и площади поверхности тела, хотя эти параметры влияют лишь на небольшую часть общей вариабельности.
Состав и форма выпуска
Лекарственная форма представлена пластырем, который является трансдермальной терапевтической системой (ТТС).
Действующие вещества в пластыре площадью 20 см² включают 6,0 мг норелгестромина и 0,60 мг этинилэстрадиола.
Каждый пластырь освобождает 203 мкг норелгестромина и 33,9 мкг этинилэстрадиола в течение 24 часов.
Другие компоненты включают адгезивную смесь полиизобутилена и полибутена, лауриллактат и кросповидон.
Пластырь представляет собой квадратную трансдермальную систему с матовой основой телесного цвета, закругленными углами, прозрачной удаляемой пленкой и бесцветным клеевым слоем.
В каждом пакете содержится один пластырь, упакованный в ламинированную бумагу и алюминиевую фольгу. Три таких пакета затем упакованы в прозрачный пакет из полимерной пленки. Затем либо один, либо три таких прозрачных пакетика (соответственно 3 или 9 пластырей) вместе с специальными наклейками на календарь для отметок об использовании пластыря (ТТС) упакованы в картонную упаковку.
Показания к применению
Пластырь евра,трансдермальная терапевтическая система, применяется для контрацепции у женщин репродуктивного возраста от 18 до 45 лет.
Пластырь евра купить вы можете онлайн у нас на сайте anc.ua, оформив бронь в ближайшей аптеке или доставку курьером по нужному адресу.
Противопоказания
- Комбинированные гормональные контрацептивы (КГК) нельзя применять при наличии одного из следующих состояний;
венозная тромбоэмболия (ВТЭ) или риск её развития:
- ВТЭ (при лечении антикоагулянтами) или ВТЭ в анамнезе (тромбоз глубоких вен или лёгочная эмболия);
- наследственная или приобретённая склонность к ВТЭ (резистентность к активированному протеину C (включая фактор V Лейдена), недостаток антитромбина III, протеина C или протеина S);
- обширные хирургические вмешательства с длительной иммобилизацией;
- увеличенный риск ВТЭ из-за наличия множественных факторов риска;
артериальная тромбоэмболия (АТЭ) или риск её развития:
- АТЭ, включая случаи в анамнезе (например, инфаркт миокарда) или предшествующие тромбозы (например, стенокардия);
- цереброваскулярные заболевания (острые нарушения мозгового кровообращения или инсульт в анамнезе);
- наследственная или приобретённая склонность к артериальному тромбозу, такие как гипергомоцистеинемия и антифосфолипидные антитела;
- мигрень с фокальными неврологическими симптомами в анамнезе;
- повышенный риск АТЭ из-за наличия множественных факторов риска или наличия серьёзных факторов риска, таких как сахарный диабет с сосудистыми симптомами, тяжёлая артериальная гипертензия, тяжёлая дислипопротеинемия;
- повышенная чувствительность к активным веществам препарата или любым вспомогательным веществам;
- подтверждённая или подозреваемая карцинома молочной железы;
- рак эндометрия или другие подтверждённые или подозреваемые эстрогензависимые опухоли;
- нарушение функции печени связанные с острой или хронической гепатоцеллюлярной болезнью;
- аденома или карцинома печени;
- недиагностированное генитальное кровотечение;
- совместное применение с лекарственными средствами, содержащими омбитасвир/паритапревир/ритонавир и дасабувир.
Особенности применения
Дети.
Пластырь евра не рекомендуется использовать у детей до 18 лет из-за ограниченности данных о его безопасности и эффективности.
Также не рекомендуется начинать использовать пластырь евра до наступления первой менструации.
Пластырь евра не рекомендуется для использования во время беременности.
Относительно влияния на грудное вскармливание, комбинированные гормональные контрацептивы, в частности пластырь евра, могут негативно влиять на качество и количество грудного молока.
Поэтому кормящим грудью матерям рекомендуется воздержаться от использования пластыря евра до окончания периода кормления грудью.
В случае возникновения беременности во время применения пластыря евра, его применение следует немедленно прекратить.
Побочные эффекты
В ходе клинических исследований выявлены следующие часто встречающиеся побочные реакции применения пластыря евра:
- нервная система: головная боль (21%), мигрени, головокружение, парестезии, тремор, эмоциональная нестабильность;
- пищеварительная система: тошнота (16.6%), боль в животе, диарея, запоры, гастрит, метеоризм, расстройства пищеварения;
- репродуктивная система: чувствительность молочных желез (15.9%), нарушения менструального цикла, вагинит, изменения в выделениях из влагалища, увеличение молочных желез;
- другие системы: увеличение массы тела, артериальное давление, сердцебиение, инфекции дыхательных путей, астма, инфекции мочевыводящих путей, мышечные боли, сыпь, алопеция.
В начале лечения также возможны мазущие выделения, увеличение молочных желез и тошнота, однако они обычно уменьшаются после первых трех циклов терапии.
Взаимодействие с другими лекарственными средствами и другие формы взаимодействий
Некоторые лекарства, такие как гидантоины, барбитураты, примидон, карбомазепин, рифампицин, окскарбазепин, топирамат, фелбамат, ритонавир, гризеофульвин, модафинил и фенилбутазон, могут увеличить скорость выведения половых гормонов, что может снизить эффективность контрацепции и привести к неплановой беременности.
Использование травяных препаратов, содержащих зверобой (Hypericum Perforatum), вместе с пластырем евра также может привести к потере контрацептивного эффекта.
Антибиотики, такие как ампициллин и тетрациклин, также могут снизить эффективность контрацепции.
При использовании пластыря евра (Evra) в рекомендованных дозах концентрации норелгестромина и его метаболитов остаются низкими, что указывает на малую вероятность клинически значимых взаимодействий с другими лекарствами.
Блок FAQ
Для чего применяют евра?
Евра пластырь предназначен в качестве контрацепции у женщин репродуктивного возраста. Безопасность и эффективность пластыря ТТС евра доказаны только для возрастной группы от 18 до 45 лет. При принятии решения о назначении евра необходимо учитывать текущие факторы риска каждой женщины, особенно относительно венозной тромбоэмболии (ВТЭ), включая риск ВТЭ при использовании евра по сравнению с другими комбинированными гормональными контрацептивами (КГК).
Можно ли забеременеть применяя евра?
Если женщина правильно применяла пластырь ТТС евра в течение последних 7 дней перед заменой, дополнительная контрацепция не требуется. Однако если прошло более 48 часов с момента замены пластыря, существует риск недостаточной защиты от беременности.
Использованная литература
https://compendium.com.ua
https://likicontrol.com.ua
https://mozdocs.kiev.ua
Преимущества и Недостатки

Советы фармацевта
Евра — цены в Аптеке АНЦ
| 💊 Категория | Евра |
| 💊 Количество товаров | 1 |
| 💊 Наименьшая цена | 615.31 грн. |
| 💊 Средняя цена | 682.31 грн. |
| 💊 Наибольшая цена | 705.59 грн. |
Отзывы покупателей о Евра пластырь ТТС №3
Користуюсь пластиром уже пів року. Зручність просто на вищому рівні: не потрібно постійно думати про графік. Єдиний момент — потрібно слідкувати за тим, щоб пластир не відклеювався під час плавання, але це рідкість.
Пластир дуже зручний у використанні. Наклеїла один раз, і можна забути про щоденне приймання таблеток. Він тримається добре, навіть під час душу, і жодного дискомфорту не відчуваю. Для мене це ідеальний варіант контрацепції, бо більше не потрібно постійно пам'ятати про таблетки.